Unbending Notes
说说中药注射剂(13)药物不良反应和不良事件差异
[引子]
下面是网上问答搜索到《搜狗问问》的一个“药品不良反应与药品不良事件区别?”匿名用户2013-09-06 回答并被选为“最佳答案”(出处:http://wenwen.sogou.com/z/q479517837.htm):

药品不良事件( ADE ):世界卫生组织将不良事件也定义为不良感受, 是指药物治疗过程中所发生的任何不幸的医疗卫生事件, 而这种事件不一定与药物治疗有因果报应关系。从药物治疗的角度出发, 我们可以得到药品不良事件的定义, 是指与药物相联系的机体损害。
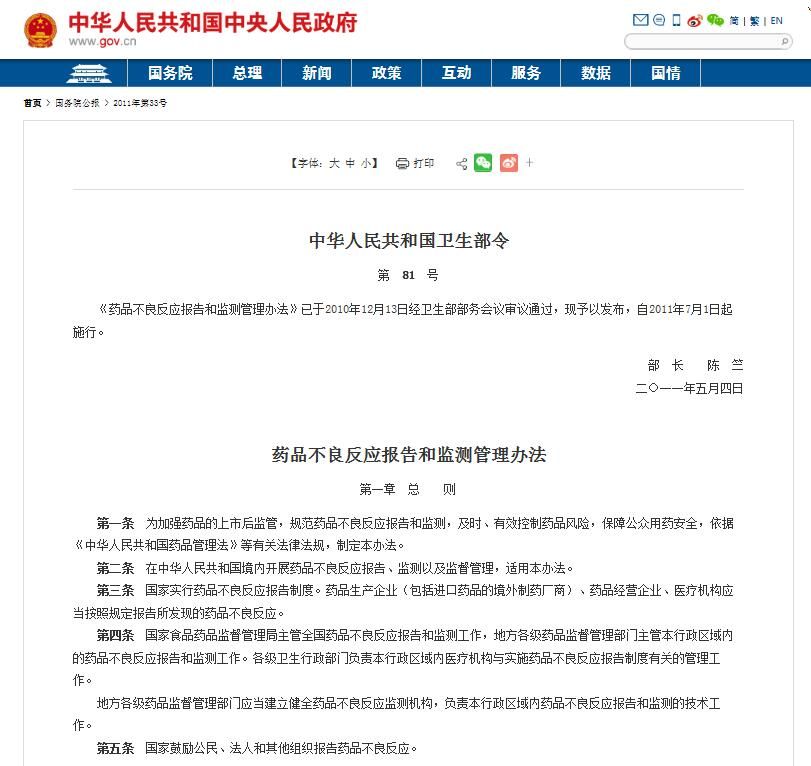
药品不良反应报告和监测管理办法
《药品不良反应报告和监测管理办法》(卫生部令第81号) 2011年5月4日 发布 第八章 附 则 第六十三条 本办法下列用语的含义:
(一)药品不良反应,是指合格药品在正常用法用量下出现的与用药目的无关的有害反应。
(二)药品不良反应报告和监测,是指药品不良反应的发现、报告、评价和控制的过程。
(三)严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1.导致死亡;
2.危及生命;
3.致癌、致畸、致出生缺陷;
4.导致显著的或者永久的人体伤残或者器官功能的损伤;
5.导致住院或者住院时间延长;
6.导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
(四)新的药品不良反应,是指药品说明书中未载明的不良反应。说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
(五)药品群体不良事件,是指同一药品在使用过程中,在相对集中的时间、区域内,对一定数量人群的身体健康或者生命安全造成损害或者威胁,需要予以紧急处置的事件。 同一药品:指同一生产企业生产的同一药品名称、同一剂型、同一规格的药品。
(六)药品重点监测,是指为进一步了解药品的临床使用和不良反应发生情况,研究不良反应的发生特征、严重程度、发生率等,开展的药品安全性监测活动。
药品不良事件包括二个要素: 一是不良事件的发生是由上市药品引起的, 二是产生的结果对人体有害。
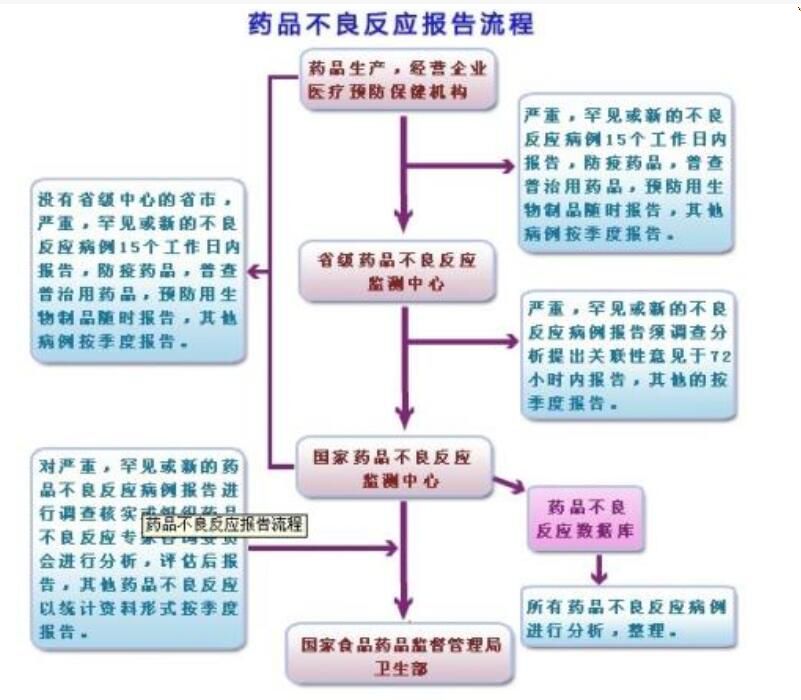
药品不良反应报告流程(卫生部令81号)
其实,药物不良反应知识中------药物不良反应和药品不良事件很多人、包括一些学过医学(兽医)专业背景的人也分不清楚,甚至参加学术问题研讨会,经常听到专家使用字母缩写的简称来讨论问题,听的云里雾里,一会儿ADR一会儿ADE的,也不知道都是什么意思。
例如:好医生官方自媒体 2016-11-02 15:31 所发的《美国打青霉素竟不需要皮试!理由很简单》(http://www.sohu.com/a/117948301_430733)一文
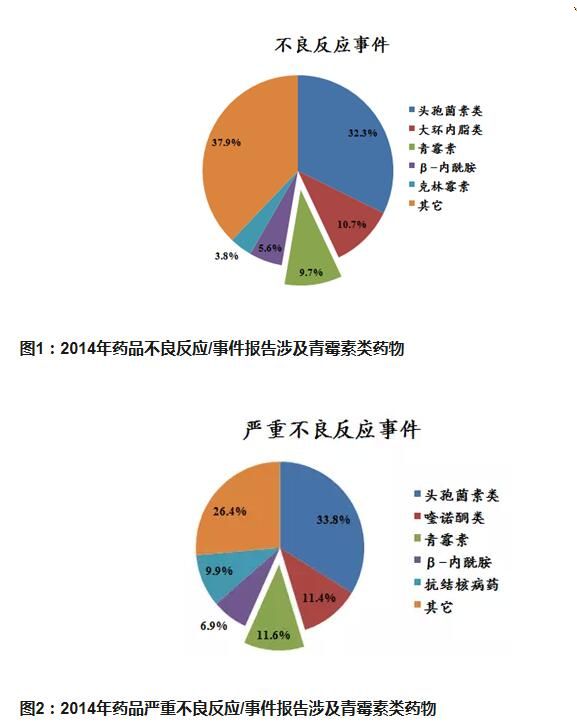
所附图表就是:2014年国家药品不良反应监测年度报告中关于青霉素类药物的不良反应事件进行梳理,在化学药品的不良反应/事件和严重不良反应/事件中,青霉素类药物占的比例分别为9.7%和11.6%,详见图1及图2。事实上,除非超大剂量使用或鞘内注射,青霉素的毒性在抗生素类药物中是较低的,排除不足0.3%的皮试假阴性者,如此高的不良反应率,药品质量问题或难辞其咎。(这个结论听了让人不太易被接受?!)
其他媒体的类似写法。
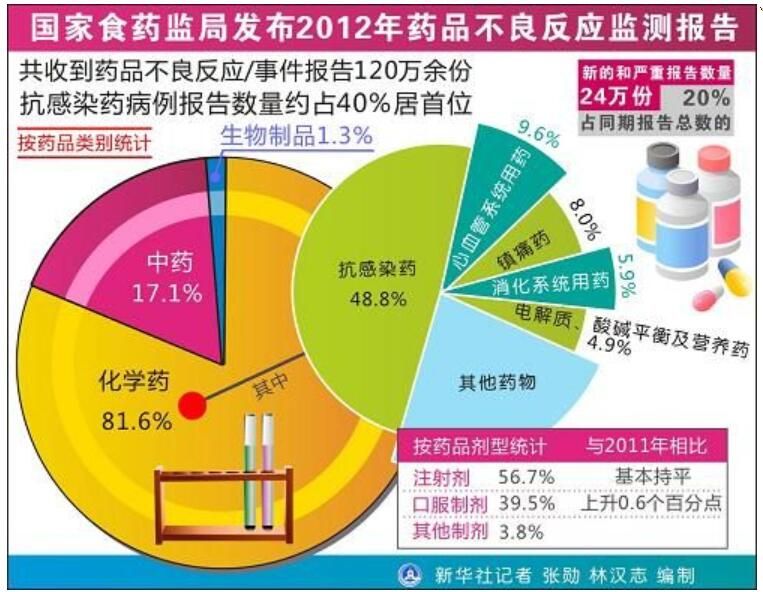
2012年SFDA发布ADR和ADE报告中药只占17.1%

这里,来给大家科普下关于药品不良反应(ADR)和药品不良事件(ADE)的区别:
ADR 定义:
药品不良反应(Adver Drug Reaction 缩写 ADR) 是指质量合格的药物在正常的用法和用量下出现的与用药目的无关的或意外的有害反应。即服用药物期间由于不同的人体特质会产生的一些不良反应,说明书上都会有详尽的服用说明。
药品不良反应实例:沙利度胺(Thalidomide)、又称为“反应停”是1956年上市治疗妊娠呕吐药物,但是上市后发现引致出生胎儿缺臂少腿,伴眼、耳、心脏、消化道和泌尿道畸形儿。5年间欧、澳、加、日、拉美及非洲等17国海豹肢畸形儿12000多人,死亡6000人。禁用沙利度胺36周后不再出现新病例。
ADE定义:
药品不良事件(Adverse Drug Event 缩写 ADE) 是指超量用药(无论是有意还是无意)、用药不当(包括滴速过快、溶媒选择不当、给药途径不当、配伍不当)以及假冒伪劣药品引起的对人的伤害。也即药品治疗过程中出现的不良临床事件,它不一定与该药有因果关系。
药品不良事件实例:2006年5月,齐二药“亮菌甲素注射液”以二甘醇代替丙二醇,广东出现急性肾衰和神经损伤严重事件,导致13人死亡。这是一个由于药品质量问题导致的药品不良事件。2017年9月23日晚间,食药监总局紧急通报:山西振动安特生物制药有限公司(简称“安特制药”)生产的红花注射液、江西青峰药业有限公司生产的喜炎平注射液在一些省份发生发热等不良反应。此外,国家食药监总局要求所有医疗机构立即停止使用涉事批次产品,责令上述两家药企立即召回涉事批次产品。这些都属企业生产质量问题,就是不良事件中的药品该批次质量问题,或称质量事件,非不良反应。
ADR 和ADE两者主要区别有以下两点:
第一是两者含义不同
药品不良事件(ADE)是指药品治疗过程中所发生的任何不幸的医疗事件,而这种事件不一定与药品治疗有因果关系。药品不良反应(ADR)是指合格药品在正常用法用量情况下出现的与用药目的无关或意外的有害反应,包括副作用、毒性作用、后遗效应、过敏反应、继发反应、特异性遗传素质等。
第二是因果关系不同
一般来说,药品不良反应(ADE)是指因果关系已确定的、与用药目的无关或意外的有害反应。而药品不良事件(ADR)是指因果关系尚未确定的反应。
[ 结论 ]
药品不良事件(ADE)包括药品不良反应(ADR),给药后可能与药物无关的可以叫不良事件(ADE ),若给药后因研究物加重应该叫不良反应(ADR)。

药品不良事件(ADE)基本上是由药品监管机构通知全面药品下架、召回、停产、查明原因再处理的处置办法,而药品不良反应(ADR)出现后,药品监管机构会采取修改《药品说明书》警示等办法处置,严重时也会全面药品下架、召回、停产、查明原因再处理的处置办法。
本文是本人以自已的专业背景、历史事件、所见所闻,表达个人对这个问题的第三只眼睛看法。文责自负,欢迎注明“沈阳(sz1961sy)”转载。
沈阳(sz1961sy)
12:59 2017-10-6 写于北京家中
【相关专题】
《中药注射剂系列》(http://w.org.cn/user1/4/subject/338.html)