Unbending Notes
说说中药注射剂(20)讲ADR必须知ADE及数据分母大小
[引子]
这个系列用了中国近44年来的“中药注射剂”研究数据,分析了自1999年来药品不良反应(ADR)报告及药品不良事件(ADE)的一系列医疗临床问题,得到了很多专家的鼓励和支持,其中,这些天在国外的《中国药典》专家,10月12日在微信上给本人发了一条信息,这样写:
“沈阳:很欣赏您的系列力作,已经讲得很清楚了,真是下了功夫了,真心为你点赞。我现正在国外,和你对话的那位是否没理解你是指分子和分母的关系?以为是指化学分子呢吧。”
这位《中国药典》专家,2013年5月本人专访过他(见 http://w.org.cn/user1/4/archives/2013/2956.html),所以,一直有联络。感谢这位专家的鼓励,同时,他这条信息提到的“和你对话的那位是否没理解你是指分子和分母的关系?以为是指化学分子呢吧”是10月12日来源于健识局的一文,下面介绍这件事。
评《毕井泉为再评价“喊话”药企,透露中药注射剂走向 》一文
此文来源于:健识局 作者:刘贺煜、陈广晶 题目是《毕井泉为再评价“喊话”药企,透露中药注射剂走向 》(http://www.sohu.com/a/197495077_564023)它的一些主要内容如下:
9月23日,CFDA通报的喜炎平和红花注射液严重不良反应问题,再次引发对中药注射剂“生死存亡”的大讨论。然而,这只是中药注射剂安全性问题的冰山一角。
梳理过去6年来的《国家药品不良反应监测年度报告》,可以看到下面这组“惊人”的数据,清开灵注射剂、双黄连注射剂、血塞通注射剂、血栓通注射剂均是不良反应报告中的常客,而处于风暴漩涡中的喜炎平、红花注射液,也不止一次在不良反应通报中“榜上有名”。
2011—2016年全国报告的中药注射剂不良反应情况汇总(表)
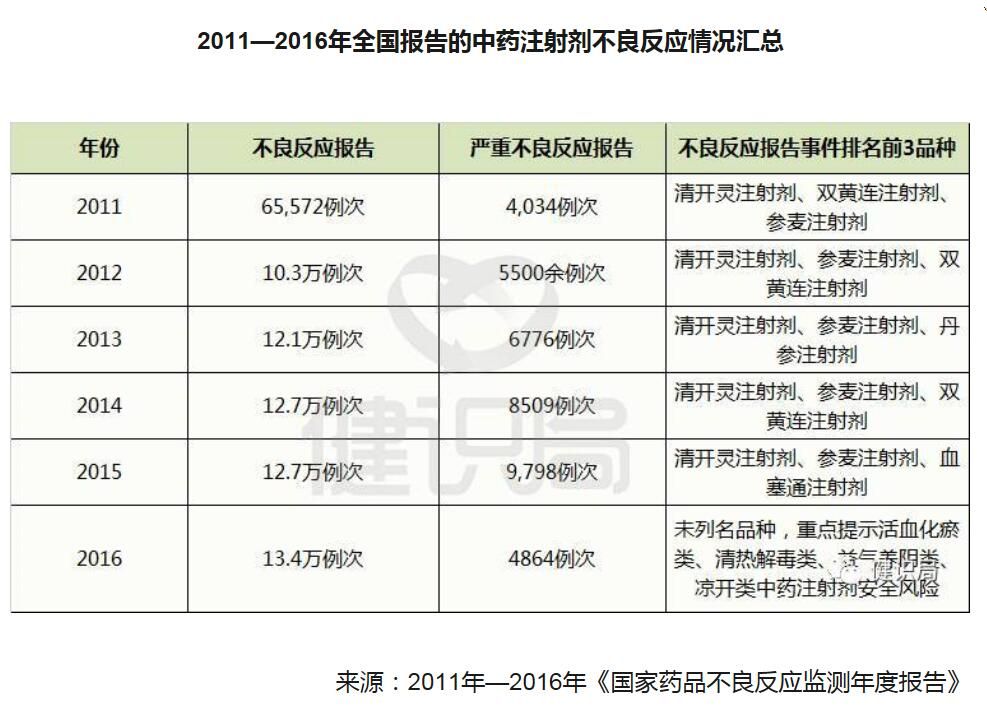
来源:2011年—2016年《国家药品不良反应监测年度报告》
【本人评论:作者显然是看不全《国家药品不良反应监测年度报告》】
上一轮再评价不了了之 不良反应和“销售神话”尴尬并存
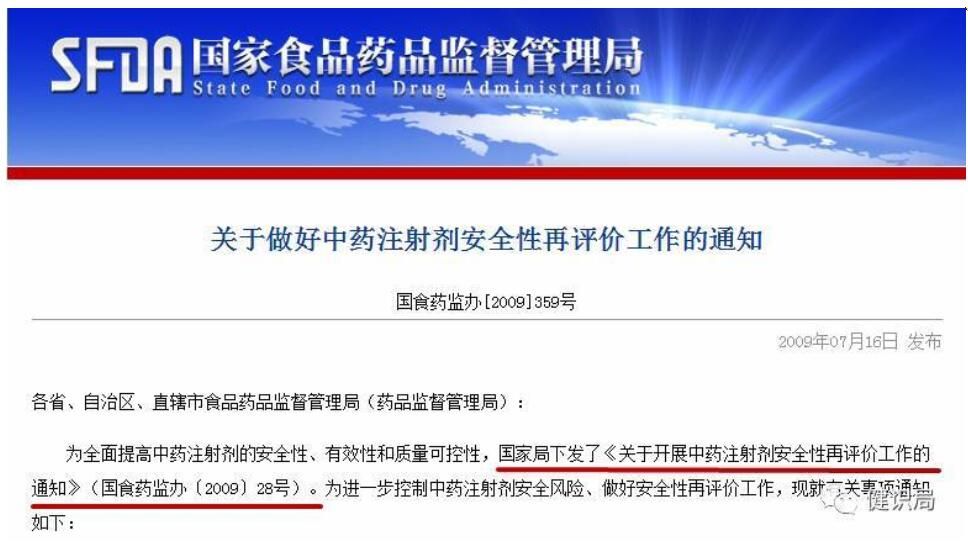
CFDA曾于2009年启动过中药注射剂安全性再评价工作。
从历年《国家药品不良反应监测年度报告》可以看出,2011年后,中药注射剂的不良反应报告、严重不良反应报告/事件“绝对数”,都在递增。【本人评论:作者显然讲ADR但是不知ADE】
另一方面,2009年到2014、2015年之间,是中药注射剂的市场大“爆发”。
据财新网报道【本人评论:作者显然不知道中药注射剂不是“通过国家质量标准”,与财新网作者一样欠专业知识】,国内已通过国家质量标准的中药注射剂超过140种,生产企业近400家。
据前瞻产业研究院2015年统计,中药注射剂近5年来的复合增长率约为22%,虽较之前30%的增长速度有所下降,但仍高于中成药15.78%和整个药品市场18.23%的收入增长速度。【本人评论:此文作者显然没有看到2016年及2017年上半年产业报告,在读“老皇历”,这个需要改进了?!】
新一轮“再评价”5-10年 中药注射剂会“消亡”吗?
在新一轮医改、药改的大背景下,中央深改小组审议通过,中办、国办联合印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》中,提出要用5—10年事件,完成注射剂进行再评价工作,显然比2009年,由原国家食药监局一个部门之力,发起的中药注射剂再评价,力度要大;明确的“5-10年“时间限定,也显得更加从容,可执行。
而健识君认为,9月23日,CFDA关于山西振东安特红花注射液和江西青峰喜炎平注射液质量问题的通告(2017年第153号)中,提出的“热原”问题,将是中药注射剂再评价的一个重点。
热原有细菌性热原(如内毒素)、内源性高分子热原、内源性低分子热原及化学热原等。如果不良反应的热原是内毒素,那么热原则是由生产不规范导致的,可通过GMP检查来监管。【本人评论:作者显然分不清什么是ADR和ADE,专业背景不够。】
微信群讨论《毕井泉为再评价“喊话”药企,透露中药注射剂走向 》一文
其实,10月12日本人在微信群上同健识局的“老板娘”,我们的媒体同行已经讨论了一次,内容比较有趣,引用供大家评品:
健识局“老板娘”: 《毕井泉为再评价“喊话”药企,透露中药注射剂走向 》
沈 阳:如此解读ADR和ADE?只读分子?哈哈哈
健识局“老板娘”: 沈老师,本文也并没有跟其他分子比啊!哈
沈 阳:让作者去读ADR报告,分清ADR、 ADE 。 连这也不读懂,会写出误导人文章。我写了18篇,基本上科普了。 学医与学药在全世界都是两个学科。
健识局“老板娘”: 科普自然有科普的意义,但这篇不是科普哈。作者只针对公众和政府监管部门关注的一个“分子”——中药注射剂谈谈行业影响 。
沈 阳:让他们写一篇西药注射剂分子的(药品不良反应),毕局长发言涉及的215个字只讲注射剂、 没有“中药”两个字定语,这是专业报道。
[小结]
一篇写行业动向的《毕井泉为再评价“喊话”药企,透露中药注射剂走向 》文章,作者连药品ADR和ADE有什么不同也分不清、然后就拿(可能是)ADR(分子)数据,去预测“行业影响”,还给CFDA的毕井泉局长套上专门向药企“喊话”的帽子,而且连再评价问题需要有什么临床技术评价条件(这是SFDA时代启动的,是毕井泉局长到CFDA之前就计划的)也是一脑浆糊,这算什么预测“行业影响”?
是不是该专业精神一点?你们健识局此文的关键词可是:“中药 /狐观医改”,都是挺专业的范畴呵。
本文是本人以自已的专业背景、历史事件、所见所闻,表达个人对这个问题的第三只眼睛看法。文责自负,欢迎注明“沈阳(sz1961sy)”转载。
沈阳(sz1961sy)
0:43 2017-10-13 写于北京家中
【相关专题】
《中药注射剂系列》(http://w.org.cn/user1/4/subject/338.html)